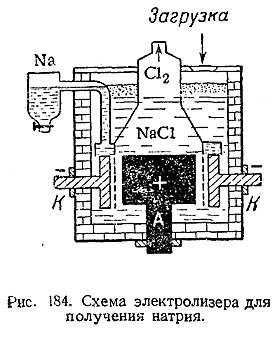
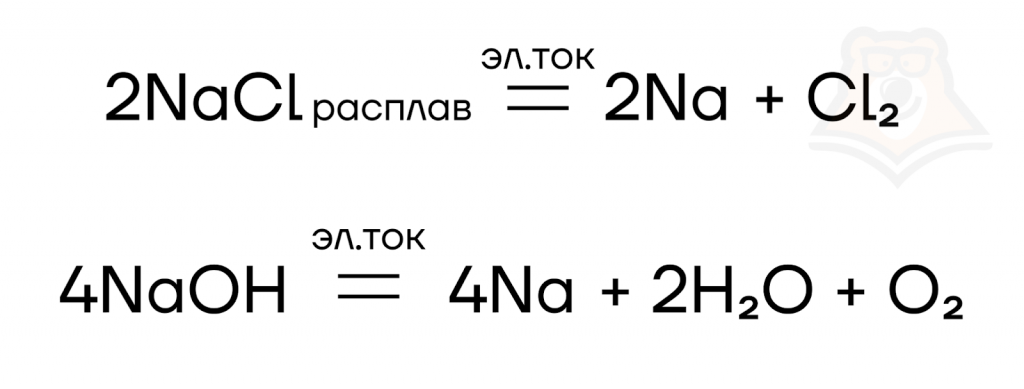Металлы IA группы
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами. Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1. Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.










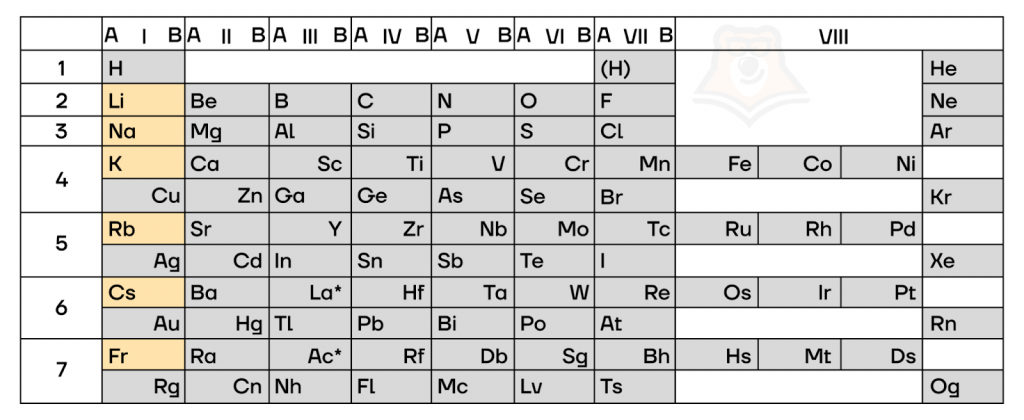
Менделеева: литий, натрий, калий, рубидий, цезий, франций. Для щелочных металлов характерны большие атомные и ионные радиусы и самые низкие значения электроотрицательности и потенциалов ионизации. Радиусы атомов в группе возрастают сверху вниз, так же увеличивается и химическая активность. Физические свойства щелочных металлов. Щелочные металлы характеризуются незначительной твёрдостью они мягкие и легко режутся ножом , малой плотностью и низкими температурами плавления и кипения. Нахождение щелочных металлов в природе.






.jpg/300px-Na_(Sodium).jpg)



Элементы 1-й группы периодической таблицы, т. Это название закрепилось за ними в связи с их сильными металлическими свойствами и способностью образовывать сильные основные щелочные гидроксиды. Чем еще отличаются щелочные металлы и какие соединения они образуют?