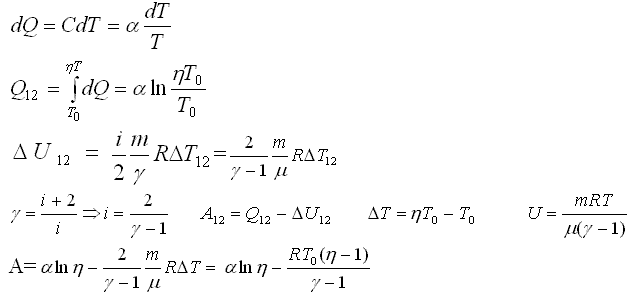
§ 246. Молярные теплоемкости
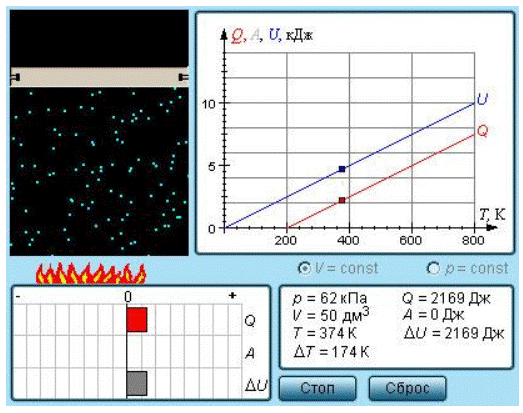
Цель работы: определить методом Клемана-Дезорма отношение теплоемкостей воздуха при постоянном давлении и постоянном объеме. Приборы и принадлежности:. U —образный водяной манометр,. В молекулярной физике термодинамическое состояние газа характеризуется параметрами состояния: давлением Р , объемом V , температурой Т , массой m и т. Уравнение, связывающие эти величины называется уравнением состояния вещества.






На значение молярной теплоёмкости влияет температура вещества и другие термодинамические параметры. Материал из Википедии — свободной энциклопедии. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 мая года ; проверки требуют 2 правки. Для образца переменного химического состава эквипарциальная молярная теплоёмкость также является переменной что сглаживается, как упоминалось выше, законом Дюлонга — Пти. Литература [ править править код ].


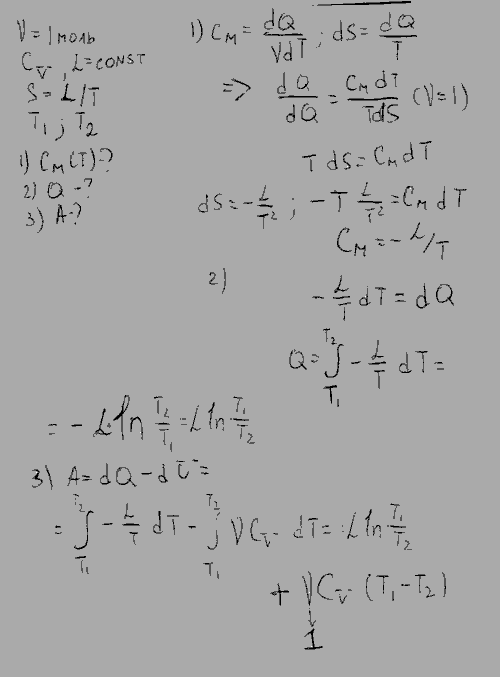

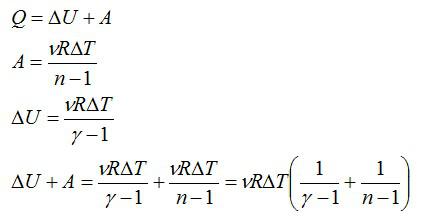
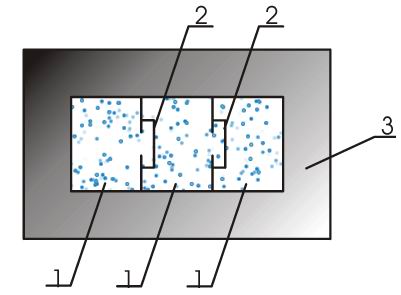
Полная теплоемкость смеси газов представляет собой сумму теплоемкостей газов, составляющих смесь. Это справедливо Рис. Удельную массовую теплоемкость смеси газов можно получить, разделив выражение 4. Получили, что удельная массовая теплоемкость смеси газов равна сумме произведений массовых долей на удельные массовые теплоемкости газов, составляющих смесь. Удельную объемную теплоемкость смеси газов можно получить, разделив выражение 4. Использование парциальных объемов правомерно, поскольку они соответствуют массовому количеству каждого газа, входящему в смесь, то есть количество теплоты можно представить выражением.